本文引自谢平科学网博客:http://blog.sciencenet.cn/home.php?mod=space&uid=1475614&do=blog&id=930806
微生物的世界离纯粹的化学性最近,离复杂的生命性最远,它们的精髓就是在飞舞的电子流动中实现能量与物质的涌动。不像那怒放的百花,那裊裊的树枝,微生物既渺小又隐匿,它们变幻无常(在生理的一切方面),飞逝匆匆。它们是生命的开拓者、探险者和创造者......
生命本质上就是其一切部分的完全流动的相互渗透,及对整体默然无关的那些部分的相互渗透
—黑格尔(Georg Wilhelm Friedrich Hegel,1770年-1831年)
生命就是趋向,而趋向的本质就是一集束(sheaf)的形式发展,依靠自身的成长,创造出不同的方向,而冲动(impetus)就在这些方向上被分化
—柏格森(Henri Bergson,1859年—1941年)
结构相对简单的原核生物乃生命之源头,这已是公认的事实。因此,探寻微生物世界是揭秘生命起源的必经之路。但是,人们面临着一个最大的难题:这些微米级的生命形式却没能留下可以辨识种类的化石记录,其实,即便是对活着的现代微生物种类的鉴定都是十分的困难与繁杂,就更不用说化石了。虽然面临形态上特征辨识的困难,但是,人们对现代各种各样原核微生物的生理与代谢已有了不少的认识,这些或许可为探寻生命的起源提供宝贵的线索。
一切生命都处于永不停息的运动与变化之中,这也是所有物质的根本属性。正如凯恩斯·史密斯(1995)所说,“原子和分子总是在移动,在旋转,在振动,在推撞,而它们在做所有这些运动时却并不需要外部动力。原子具有的永恒运动的特性早就为希腊哲学家预言过……分子也运动,只是分子越大,其运动速度也就越慢”。只是与非生命的物质形态相比,生命物质的运动形式出现了质的飞跃,常常被称为神秘的“活力”。
我们说,生命既是物质的,也是能量的,是因为能源为物质性的生命机器之运转提供了动力。生物体内的能量流动是如何得以实现的呢?它是通过电子与质子的转移。携带着能量的电子和质子的流动是生命系统中一切生物合成的基础,它离不开氧化与还原反应的耦联以及一些十分精巧的电子传递链。
本文主要介绍原核微生物(真细菌和古菌)的代谢,它们复杂的能源和碳源利用方式,以及各种微生物—化能细菌、非产氧的光能细菌等的电子传递链及CO2的还原方式(关于产氧的蓝细菌相关的问题将在以后详细介绍)。对这些原核微生物的认知将是人们打开通向神秘的生命起源之门的钥匙,因为所谓的共同祖先应该就是它们的近亲。
一、生命的本质—电子(质子)驱动的元素组合游戏
现已发现的化学元素多达110种,也就是说虽然有这么多不同种类的原子,但构成有机物最常见的原子却仅有C、H、O、N、P和S。从结构上来说,任何一种原子都是由电子、质子和中子所构成,而原子结合在一起就形成分子。一个分子存在的时间有长有短,也有大有小,譬如,最小的分子仅由2个原子组成,而大的分子可包含数以千万计的原子。
1. 细胞内能量转换的基础—氧化还原反应的耦联
电子是一种神奇的带电粒子,其质量很小。形象地说,电子就像是一种万能的粘合剂,正是它把不同的原子键合成各种各样的分子(它还能把不同的分子也聚合在一起)从而形成了宇宙中的万物,而它的离合也驱动了万物的变迁。电子可以共享,也可以转移,一些类型的原子容易失去(如Na+)或共享电子,而另一些原子则容易接受电子(如Cl-1)。失去电子的原子带正电,获得电子的原子带负电。此外,还存在一个重要的原则—同种电荷相排斥,异种电荷相吸引。在包括生命在内的所有物质中,氢(H)是最轻的元素(原子最小),也是宇宙中含量最丰富的元素,它既能与其它元素共享电子(如C-H),也能失去电子变成H+,因为氢的原子序数是 1,H+不带电子,只有由一个质子组成的原子核,是一个“赤裸的电荷”,具有极强的化学反应性。
从物质中移去电子(一或多个)叫做氧化反应,而物质接受电子(一个或多个)叫做还原反应。在生化反应中,氧化还原作用既指电子传递,又指氢原子(含一个电子和一个质子)的传递。由于电子不能在溶液中存在,它们必须是原子或分子的一部分,这样,在氧化—还原反应中,同时需要电子供体和受体。这就是说,任何一个氧化反应的发生必须伴随一个相应的还原反应。这里,被氧化的物质就是电子供体,而被还原的物质就是电子受体。一系列的氧化与还原反应的耦合就形成电子的流动,这是生物体内一切生化反应体系存在的基础。
在生命系统中,这种电子流动之所以重要,是因为它伴随着能量的变化,从而可使一种能量(如光能,通过激发电子)转化为另一种能量(如化学能)。光合生物的光合作用就是基于这样的原理,它通过一种复杂的光化学反应,能将光能转化成化学能,储存于高能化合物ATP(三磷酸腺苷)和强还原性物质NADPH(烟酰胺腺嘌呤二核苷酸磷酸)之中,并进一步用于将CO2还原为糖类(也储存了化学能)等大分子有机化合物。光合作用是地球上最重要的一种生物化学反应,其实质是包含了一系列氧化还原反应。
当有机(如糖)或无机化合物被氧化时释放出的能量叫化学能。在生物体内,一些有机化合物氧化时所释放出来的化学能通常又以高能磷酸键的形式重新储存起来,进一步支撑细胞内的其它需能反应。ATP就是一种能量货币,是一种重要的能量载体,它在放能反应中形成,又可用于吸能反应。除此之外,在生物体内的高能化合物还有辅酶A衍生物(如乙酰辅酶A)等。
生化反应的一个重要特点就是放能反应和吸能反应相耦联,因为能量是守恒的。正如考夫曼(2004)所说,“两个复杂有机分子上的电荷分布,让它们彼此靠近,并与平动、振动和转动模式相结合,那么,这种电荷分布就可精密地测量相对平衡态的偏离,再与这些偏离相结合,就可获得相互连接的被催化的放能反应和吸能反应”。
2. 细胞内能量转换的核心过程—电子传递链
电子如何在不同的有机化合物之间进行传递呢?这与所谓的还原电势密切相关。物质被氧化时释放出电子的能力会不同,物质被还原时接受电子的能力也会不同。这种倾向能力可用还原电势(E’0)来表征,当书写氧化—还原(O-R)偶极对时,将氧化态放在左侧。生物化学上一些重要的氧化还原对的还原电位如表8-1所示,顶端的还原电势具有较大的负值,因而具有较强的提供电子的倾向(接受电子的能力就较弱),而底部的还原电势具有较大的正值,因而具有较强的接受电子的倾向(提供电子的能力就较弱),因此,顶部右侧的物质为最强的还原剂,而底部左侧的物质为最强的氧化剂,电子自上而下进行传递。
在这种电子传递过程中,能量如何变化呢?根据还原电位可预测氧化—还原反应的产能状况:当电子从顶部向下传递时,它可以被不同水平的电子受体所捕获;在捕获之前,电子降落得越远,电子供体和电子受体之间的还原电势差就越大,所释放出能量就越多,这就如同水从高处跌落到低处的情形一样,跌的“落差”越大,释放出的势能(转化成动能或电能)也就越大。还原电势差越大,就越能允许较长的电子传递链的存在,反之就会越短,产能效率及代谢速率也越低,而且还可能需要一些逆向的电子传递过程来完成NAD(P)H的生成。
从表1不难看出,除了N2O/N2外,O2/H2O的氧化性最强,因此,对同样的电子供体而言,当O2作为电子受体时所产生的能量比其它的电子受体多。此外,很多分子既可以作为电子供体也可以作为电子受体,这取决于它们与何种(氧化—还原对)物质进行耦联。
有如此之多的不同还原电位的氧化—还原对,这就为生化反应中多种多样的电子传递链(包含多个中间电子载体)的存在提供了可能。一般来说,电子是按表1所示自上而下进行传递,但是,生物也有办法进行逆向电子传递,只是需要外加能量的推动。在电子传递链中,起始供体称为原电子供体,最后的电子受体称为终电子受体。有些电子载体与膜紧密结合,有些则能自由扩散,如NAD+和NADP+(它们还是氢原子的载体)。
当然,既使具有同样的还原电位,不同氧化—还原对在生化反应中的角色可能截然不同。譬如,NAD+/NADH和NADP+/NADPH电极对的还原电位均为-0.32V,它们都是很好的电子供体,但NAD+/NADH直接参与产能(分解反应),而NADP+/NADPH则主要参与合成反应。
考夫曼(2004)说,“细胞和有机体具备了精密的探测器,它能测量能源,并与耦合装置一道提取功,然后用于构建自身的大致拷贝。因此,细胞中的新陈代谢就是一个耦合了的化学反应网,简单分子、复杂分子和非常复杂的有机分子无所不包,从二氧化碳到由成千上万的氨基酸所组成的蛋白质”。然而,两种相对简单的化合物—ATP和NADPH则是一切复杂生化反应网络的不可替代的核心,细胞对能量的管理和物质的重构主要是通过它们来实现的。
表1 生物化学上一些重要的氧化还原对的还原电位
|
氧化还原对 |
E’0(V) |
|
SO42-/HSO3- |
-0.52 |
|
CO2/甲酸根离子 |
-0.43 |
|
2H+/H2 |
-0.41 |
|
S2O32-/HS- + HSO3- |
-0.40 |
|
铁氧还蛋白(氧化/还原) |
-0.39 |
|
黄素氧还蛋白(氧化/还原)a |
-0.37 |
|
NAD+/NADH (NADP+/NADPH) |
-0.32 |
|
细胞色素c3(氧化/还原) |
-0.29 |
|
CO2/乙酸 |
-0.29 |
|
S0/HS- |
-0.27 |
|
CO2/CH4 |
-0.24 |
|
FAD/FADH |
-0.22 |
|
SO42-/HS- |
-0.217 |
|
乙醛/乙醇 |
-0.197 |
|
丙酮酸/乳酸- |
-0.19 |
|
FMN/FMNH |
-0.19 |
|
磷酸二羟二酮/磷酸甘油 |
-0.19 |
|
HSO3-/S3O62- |
-0.17 |
|
铁氧还蛋白(氧化/还原)a |
-0.12 |
|
HSO3-/HS- |
-0.116 |
|
甲基萘坤(氧化/还原) |
-0.075 |
|
APS/AMP+HSO3- |
-0.060 |
|
红素氧还蛋白(氧化/还原) |
-0.057 |
|
丙烯酰-COA/丙酰COA |
-0.015 |
|
甘氨酸/甘氨酸根离子+NH4+ |
-0.001 |
|
S4O62-/S2O32- |
+0.024 |
|
延胡索酸2-/琥珀酸2- |
+0.033 |
|
细胞色素b(氧化/还原) |
+0.035 |
|
泛醌(氧化/还原) |
+0.113 |
|
A3O43-/ASO33- |
+0.139 |
|
二甲基亚砜(DMSO)/二甲基硫(DMS) |
+0.16 |
|
Fe(OH)3+HCO3-/FeCO3 |
+0.20 |
|
S3O62-/S2O32- + HSO3- |
+0.225 |
|
细胞色素c1(氧化/还原) |
+0.23 |
|
NO2-/NO |
+0.36 |
|
细胞色素a3(氧化/还原) |
+0.385 |
|
NO3-/NO2- |
+0.43 |
|
SCO42-/SeO32- |
+0.475 |
|
Fe3+/Fe2+ |
+0.77 |
|
Mn4+/Mn2+ |
+0.798 |
|
1/2O2/H2O |
+0.82 |
|
NO/N2O |
+1.18 |
|
N2O/N2 |
+1.36 |
a在这个双电子传递中,给出的是每传递一个电子的分离电位
(引自马迪根等2001)
3. 微生物的能源和碳源—多样而复杂
除了存在极少数无机化能细菌外,地球上生命占绝对优势的能量来源为太阳光能,而构建大分子有机化合物骨架的物质基础则是碳。对真核的自养生物(如高等植物、藻类)来说,其能量来自太阳光能,而碳源则来自大气中的CO2,但是对原核的微生物来说,情况就要复杂得多。
一些微生物能够利用光作为能源(称为光能细菌),另一些能以化合物作为能源(称为化能细菌),其中以有机化合物作为能源的称为化能有机营养细菌,以无机化合物作为能源的称为化能无机营养细菌。光养细菌的碳源既可来自无机物,也可来自有机物,既可利用H2O作为电子供体,也可利用H2S或H2作为电子供体(表2)。
自然界中的化能自养菌种类并不多,它们氧化无机物的专一性很强,譬如硝化杆菌只能氧化亚硝酸盐。此外,同样的无机化合物也能被不同类群的细菌所利用,譬如,能氧化硫化合物的既有化能细菌,也有光能细菌。光合细菌都是具有色素(细菌叶绿素、类胡萝卜素)的厌氧细菌(多栖息于含H2S的厌氧水域中),而化能细菌一般都是不含色素的好氧菌。
为何原核微生物的能源和碳源是如此的多样而复杂呢?这或许反映了它们具有更广泛的适应性或更大的可塑性,或许这些机制或类型正好反映了它们起源与进化过程中的阶段性遗迹。
不仅如此,同一种微生物也能呈现出惊人的代谢可塑性。如一种嗜热光合菌—光合绿丝藻(Chloroflexus aurantiacus)的营养方式多种多样,它不仅可在厌氧条件下进行光合异养或光合自养,还可在好氧条件下进行有机异养(Krasilnikova et al. 1986)。
表2 能量代谢和碳代谢以及为微生物的营养类型
|
碳源 |
能源 |
||
|
|
光 |
无机物 |
有机物 |
|
无机物(CO2、HCO3-、CO32-) |
光养真核微生物;蓝细菌(光合自养,H2O是电子供体) |
化能自养菌:氢细菌、硫细菌、铁细菌、硝化细菌 |
未知 |
|
紫色细菌和绿色细菌(光合自养,H2S或H2是电子供体) |
|
|
|
|
有机物 |
紫色细菌和绿色细菌利用有机碳源(光合异养) |
兼养微生物 |
化能有机营养菌(大多数原核,所有非光养真核微生物) |
(引自马迪根等2001)
二、化能细菌的电子传递链
一些原核生物能从还原性物质中获取能源以固定CO2,这些生物称为化能无机营养型(chemolithotrophs),作为电子供体的还原性无机物包括氮化合物、硫化合物、Fe[II],H2和CO,CO2固定主要是通过卡尔文循环,但也存在一些特殊的途径,譬如逆向的TCA循环、乙酰辅酶A途径和3-羟丙酸循环等(Kim & Gadd 2008)。
自养生物的CO2的固定需要ATP和还原力(NADPH或NADH)的参与,因此,这是所有自养生物(无论是光能自养还是无机化能自养)为了生物合成所必须解决的关键问题。ATP的合成是通过膜内外H+浓度的梯度(电势梯度)来进行的,而NAD(P)H则需要依赖电子传递链,由于偶极对NAD+/NADH (NADP+/NADPH)的被还原的物质具有较高的电势能(即接受电子的能力较弱,势能是指把一物质抬高所需的能量),无论光养细菌还是化养细菌,在很多情况下,逆向的电子传递对还原力的合成来说都是一个关键的特征。
1. 氨和亚硝酸盐氧化细菌
能被用作电子供体的最常见的无机氮化物为氨(NH3)和亚硝酸盐(NO22-),它们可被硝化细菌(Nitrifyingbacteria)氧化(好氧)。硝化细菌包括两类:亚硝酸细菌(又称氨氧化菌)将氨氧化成亚硝酸,硝酸细菌(又称亚硝酸氧化菌)将亚硝酸氧化成硝酸。因为没有一种细菌能够直接把氨转变成硝酸,因此硝化作用必须通过这两类菌的共同作用才能完成。
亚硝酸细菌(如欧洲亚硝化单孢菌Nitrosomonas europaea)对NH3的氧化是通过NH2OH和NOH两个步骤进行的,反应由氨单加氧酶(AMO)和羟胺氧化酶(HAO)所催化。AMO需消耗2个电子来将NH3氧化为NH2OH,因NH2OH/NH3的还原电位(+0.899V)高于½O2/H2O(+0.82V),这两个电子来自还原态的Cyt c552(通过细胞色素P450介导)。NH2OH的氧化与Cyt c544相偶联,这一氧化过程释放4个电子,其中2个被AMO消耗用于NH3的氧化,另外的1.65个电子经细胞色素氧化酶产生质子动力势,而剩下的0.35个电子通过逆向电子传递用于还原NAD+;因此从Cyt c到NAD(P)+的逆向电子传递消耗的能量是正向电子传递产生能量的5倍(图1)。
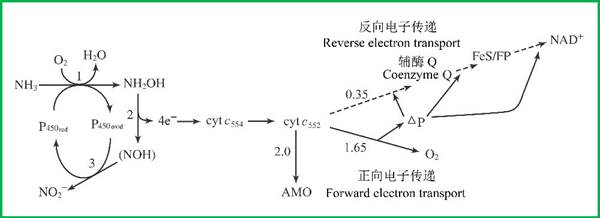
图1 亚硝酸细菌将氨氧化为亚硝酸盐(Kim & Gadd 2008)
运动亚硝化球菌(Nitrosococcusmobilis)氧化亚硝酸盐获得电子以还原Cyt a1,其中一些电子被用于还原O2,形成质子动力势(正向电子传递),其余的电子逆向传递到NAD(P)+获得用于生物合成的还原力(图2),后一过程需要消耗质子动力势,因此被称为逆向电子传递(Kim & Gadd 2008)。
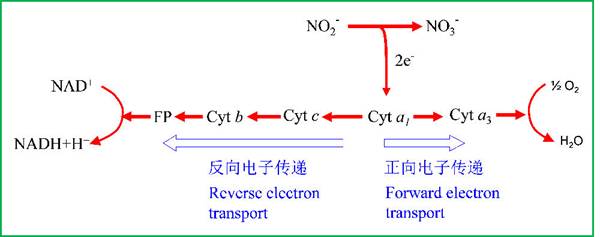
图2 亚硝酸盐氧化菌—运动亚硝化球菌(Nitrosococcus mobilis)的为了还原NAD(P)+的逆向电子传递(仿Kim & Gadd 2008)
硝酸细菌在亚硝酸盐氧化还原酶(nitrite oxidoreductase,NOR)的催化下,将亚硝酸盐氧化为硝酸盐,并还原Cyt a1。NOR是一个铁-硫-钼蛋白,也是电子传递链(从亚硝酸盐到分子氧)的一部分。氢阴离子(H-)从NOR传递到Cytc时需要消耗内部的负膜电位,因此是一个上坡反应(uphill reaction)(图3)。
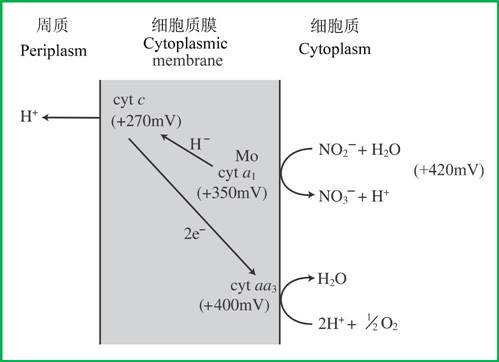
图3 维氏硝化杆菌(Nitrobacter winogradskyi)在亚硝酸盐氧化过程中的电子传递(引自Kim & Gadd 2008)
2. 铁氧化菌
一些细菌(如Gallionella ferruginea、Thiobacillus ferrooxidans、Leptospirillum)和古菌(Sulfolobus acidocaldarius、Acidianus brierleyi、Ferroplasma)可将亚铁离子(Fe2+)氧化为铁离子(Fe3+)而获取能量,称为铁氧化菌。有些铁氧化菌(如Thiobacillus ferrooxidans, Sulfolobus acidocaldarius、Acidianus brierleyi)也可以还原性硫化物作为电子供体自养生活(Kim & Gadd 2008)。
氧化亚铁硫杆菌的电子传递链系统很短,仅由细胞色素c、a1及一种含铜的铁硫菌蓝蛋白组成,因为Fe3+/Fe2+的正电势很高(pH=3时,E’0= +0.77V),与氧(1/2O2/H2O,E’0 = +0.82V)很接近。这样,Fe2+氧化产生的电子不足以还原NAD+、FAD和许多其它的电子传递链成分(图4)。
嗜酸的氧化亚铁硫杆菌其内部pH约为6,而它周围环境中的pH接近2,因此,细胞质膜两侧的pH值差异形成了天然的质子浓度梯度,可推动ATP的合成因为Fe2+到Fe3+的氧化反应消耗质子,与ATP酶进入的质子形成平衡,维持了细胞质膜内外的质子梯度(马迪根等2001)。
铁氧化细菌还需利用跨膜电位的能量逆向电子传递生成NADH和NADPH,由于Fe3+/Fe2+电偶的正电势很高,使得这个过程需要大量的能量,因此这类细菌的生长缓慢,倒是可以形成大量的铁离子沉积物(马迪根等2001)。
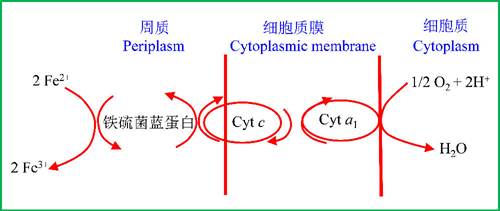
图4 氧化亚铁硫杆菌(Thiobacillus ferrooxidans)的电子传递系统,Cyt是细胞色素(仿马迪根等2001)
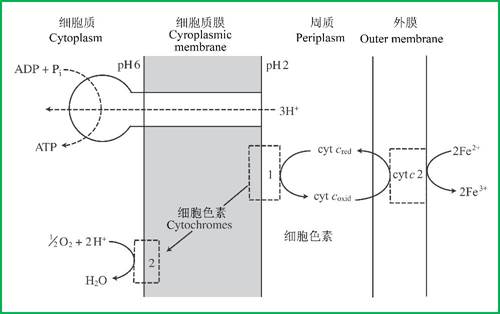
图5 氧化亚铁硫杆菌(Thiobacillus ferrooxidans)伴随Fe2+的氧化进行的ATP合成。cyt cred = cyt c还原,cyt coxid = cyt c氧化,(引自Gottschalk 1986)
3. 无色硫细菌
能氧化硫化合物的细菌分为两类:光能营养菌和化能营养菌。前者是含色素的厌氧光合菌(在后面介绍),后者是缺乏色素的好氧菌。作为能源的硫化物有H2S、HS、元素态硫(S0)和S2O32-等,终产物多为硫酸盐(SO42-),绝大多数还原态硫化物(H2S)的氧化过程是逐步进行的。
图6是典型硫氧化细菌的电子传递系统,还原态硫化物的电子从不同的位置进入链(依赖于它们的还原电势),并传递给O2,整个过程导致质子动力势的形成,通过膜结合ATP酶合成ATP,而CO2还原过程的电子为逆向传递,最终得到NADPH
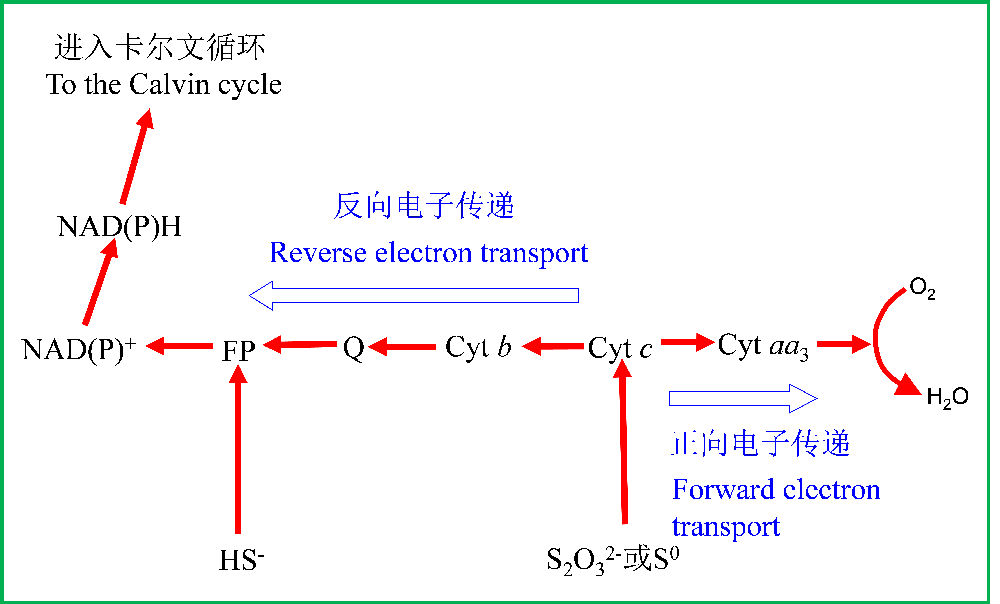
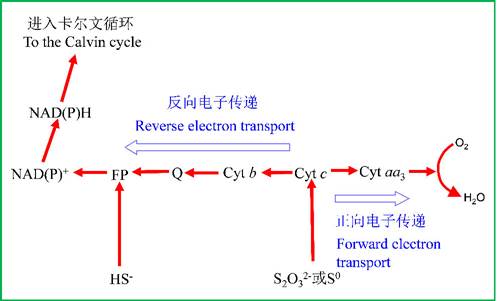
图6 典型硫氧化细菌的电子传递系统,生长在硫磺,硫化物,硫代硫酸盐,注意ATP合成的电子传递与反电子传递方向。FP指黄素蛋白;Q为醌;Cyt是细胞色素(仿马迪根等2001)
4. 氢氧化细菌
一些化能无机营养菌能将氢做为能源,通常需氧,但也能进行厌氧呼吸。大多数氢细菌营兼性化能营养。当进行自养生长时,氢化酶催化氢气最初的氧化,电子被传递给受体醌,来自还原态的醌的参与电子传递链的电子继续传递,以致产生一个质子动力,通过结合在膜上的ATP酶形成ATP(马迪根等2001)。
真氧产碱杆菌(Ralstonia eutropha)有一个依赖于NAD+的溶解性氢化酶(除了颗粒性酶以外),该溶解氢化酶还原吡啶核苷酸用于生物合成,而颗粒氢化酶则引导电子从氢直接到电子传递链以产生质子动力势(图7)。
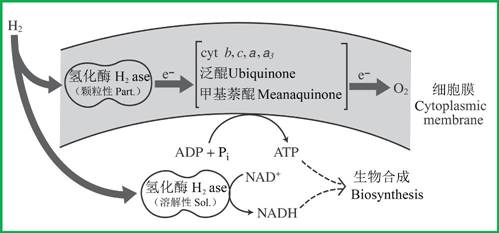
图7 真氧产碱杆菌(Ralstonia eutropha)的氢能利用(引自Gottschalk 1986)
除专性化能的嗜热氢杆菌(Hydrogenobacter thermophilus)利用逆向TCA 循环(reductive TCA cycle)固定CO2外,所有其它氢细菌均通过卡尔文循环固定CO2(Kim & Gadd 2008)。
三、不产氧光合菌的电子传递链
蓝细菌产生氧气,它们有两种光系统(I和II),有能够裂解水的锰聚集体。而光合细菌不产生氧气,只有一种光系统,也没有锰聚集体,因此,它们只能以其它无机或有机物质作为电子供体。
1. 光合细菌特性的比较
依据光合色素和电子供体的不同可将光合细菌区分成若干类型(表3):紫细菌(purple bacteria)、绿细菌(green bacteria)和螺旋菌(heliobacteria)。紫细菌再进一步分为紫色非硫细菌(purple non-sulfur bacteria)和紫色硫细菌(purple sulfur bacteria),绿细菌再进一步分为绿硫细菌(greensulfur bacteria)和丝状非产氧光合细菌(filamentous anoxygenic phototrophic bacteria)。绝大多数光合细菌都含有细菌叶绿素a,有一些的电子供体既可以是无机化合物,也可以是有机化合物。光合细菌的碳源主要是CO2,但有些类群可以利用有机物作为碳源。
不同的非产氧光合细菌不仅在光合色素上有所不同,在光合膜系统上也存在一定差异。紫细菌的光合膜系统为菌褶、微管或与质膜连续的小泡,绿细菌为与质膜附着但不连续的绿色体,而螺旋杆菌缺乏内膜系统,其光合色素位于质膜上。
表3 光合细菌特性的比较
|
特性 |
紫色非硫细菌 |
紫色硫细菌 |
绿硫细菌 |
丝状非产氧光合细菌 |
螺旋菌 |
好氧非产氧光合细菌 |
|
BChl |
a, b |
a, b |
a, c, d, e |
a, c, d |
g |
a |
|
H2S作为电子供体 |
±I |
+ |
+ |
+ |
— |
— |
|
S累积 |
— |
胞内II |
胞外 |
— |
— |
— |
|
H2作为电子供体 |
+ |
+ |
+ |
+ |
— |
— |
|
有机物作为电子供体 |
+ |
+ |
— |
+ |
+ |
+ |
|
碳源 |
CO2 |
CO2 |
CO2 |
CO2 |
有机物 |
有机物 |
|
好氧呼吸 |
+ |
— |
— |
+ |
— |
+ |
|
CO2固定 |
卡尔文循环 |
卡尔文循环 |
还原性三羧酸循环 |
卡尔文循环III |
— |
— |
|
反应中心 |
BPh—Q |
BPh—Q |
FeS |
BPh—Q |
FeS |
BPh—Q |
(引自Kim & Gadd 2008)
I依不同的株而变化
II外硫红螺旋菌科(Ectothiorhodospiraceae)在胞外累积硫磺颗粒
III绿屈挠菌属Chloroflexus采用3-羟丙酸循环(3-Hydroxypropionate cycle)的方式
BPh—脱镁细菌叶绿素,Q为醌
2. 不产氧光合菌的电子传递链
与放氧的蓝细菌一样,紫细菌、绿色硫细菌和螺旋杆菌的电子传递链都起始于一个由光能驱动的光反应中心色素分子的激发态(只不过不是叶绿素分子,而是细菌叶绿素分子)。在紫细菌中,电子经质醌Q(还原电位E’0= +0.113V)传给NAD+/NADH(还原电位E’0= -0.32V),因此还必须进行一个反向(上坡)电子流动,而在绿色硫细菌和光细菌中则不需要这样(图8)。在这三类光合细菌的电子传递链中,叶绿素(或细菌叶绿素)、细胞色素和质体醌(Q)都不可或缺,有些还需要铁—硫中心(FeS)。
看来叶绿素或细菌叶绿素分子对几乎所有的光合生物(除了下面要讲的利用视紫红质进行光合作用的古菌外)来说具有不可替代的功能,没有它们,就无法利用光能来启动电子传递链,因为它们能被光激发产生很大的还原电势差,即在激发态具有很高的负电势而呈现出很强的提供电子能力(强还原剂),而失去电子的叶绿素或细菌叶绿素分子对又能在很高的正电势下重新获得电子(强氧化剂)。因此,可以这样说,没有叶绿素分子就不可能有光系统,而且还没有任何其它的色素分子可取代光系统中叶绿素分子扮演的重要角色。
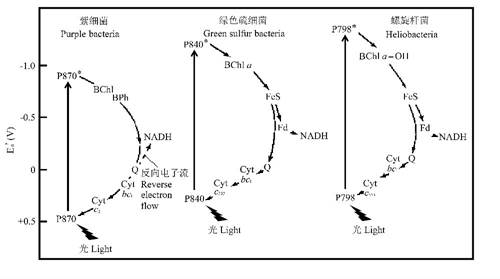
图8 不产氧的光合菌—紫细菌、绿色硫细菌和螺旋杆菌中电子流的比较。BChl—细菌叶绿素,BPh—脱镁细菌叶绿素,P870和P840分别是紫细菌和绿细菌反应中心的特殊对细菌叶绿素(*表示光激发态),均由BChl a组成,光细菌反应中心的P798含BChl g(引自马迪根2001)
四、一种特殊的“光合作用”
1. 视紫红质—特殊的光感受体
20世纪70年代,在极端嗜盐古菌Halobacterium salinarum中发现了一种称为视紫红质(rodopsin)的物质,由视蛋白(opsin)和视黄醛(retinene)共价结合而成,这是一类色素蛋白复合体,一种特殊的光感受体。
视紫红质分为I型和II型,I型视紫红质最早发现于H. salinarum中,在这种细菌中含有四种视紫红质—Bacteiorrhodosin(Br,质子泵)、Halorhodopsin(Hr,氯离子泵)及两种 Sensoryrhodopsin(SR I 和II),II型视紫红质主要分布于高等真核生物,包括动物眼睛中的视紫红质、人类的杆细胞和锥细胞的视觉色素、低等脊椎动物的松果体和丘脑等中。编码与Bacteiorrhodosin有同源性的蛋白(命名为Proteorhodopsin,简称PR)的基因广泛存在于淡水水域与海水水域的细菌中,这些细菌大多属于α型变形杆菌(α-Proteobacteria)、γ型变形杆菌(γ-Proteobacteria)和拟杆菌属等(王宁等2010)。
2. 感光分子—视黄醛的工作原理
通过光诱导的结构变化推动质子的跨膜传送:感光分子—视黄醛通常以全—反式结构存在于膜内侧,它可被光激发转换成顺式状态,其结果使H+转移到膜外,随着视黄醛分子的松弛和质子的吸收,又转变回较稳定的全—反式状态,又再次被光激发,转移H+,如此循环(图9)。正是这种跨膜的H+梯度可在ATP酶的催化下完成ATP的合成。
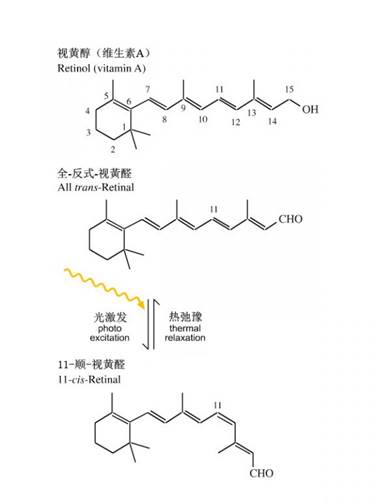
图9 在光的驱动下,视黄醛在反式与顺式异构体之间的切换(来源:http://www.meta-synthesis.com/webbook/17_photo/photo.html)
对光养或无机化养微生物来说,跨膜质子梯度和ATP合成酶是ATP生成的必要条件。而放氧光合生物通过水的裂解(类囊体膜内)既提供了电子,也释放出H+从而形成了跨膜H+梯度,使ATP合成酶利用跨膜的质子动力势将ADP转化成ATP,在这一过程中释放到类囊体膜外的H+又可与高能的电子一道用于形成还原力—NADPH,这就解决了H+在细胞中的堆积问题。显然,光合放氧生物的ATP生产模式得到了自然界更大的青睐。为何这种与视紫质偶联的相对简单的ATP的生成方式与蓝细菌通过与复杂的光系统I和II偶联而生成ATP的方式相比不那么普遍呢?
3. 同样的感光物质服务于完全不同的生存目的
迄今为止,已发现了数千种不同的PR基因,视紫红质广泛存在于各种古菌和真细菌之中。但是,令人惊讶的是,它也存在于动物的视觉细胞中。为何动物视觉借用了这种古菌和细菌中的感光物质(视黄醛)而不是其它的感光物质(如叶绿素、类胡萝卜素等)?
视黄醛从何而来呢?β—胡萝卜素和视黄醇(醛)之间在结构上存在同源性,β—胡萝卜素在氧化酶催化下可裂解为2分子视黄醇(醛),视黄醇在醇脱氢酶作用下转化为视黄醛。
显然,在结构上同源的感光物质在进化的过程中被不同的生物类群用于了完全不同的生存目的:在放氧光合生物中,类胡萝卜素参与光能的吸收和传递,并可淬灭激发态的叶绿素而保护后者;在一些古菌中,其氧化产物—视黄醛与视蛋白结合成视紫质,利用光能形成跨膜的H+梯度为ATP的合成创造条件,推动光能向化学能的转变;而在动物的视觉细胞中,视紫质通过复杂的生化反应可将光能转化成为神经信号。这纯粹是一种偶然还是偶然中的必然呢?
五、细菌特殊的CO2固定方式
对自养生物来说,必须利用高能化合物(ATP)和还原力(如NADH或NADPH)固定CO2。大多数细菌(蓝细菌、绝大多数光合细菌、全部好氧的化能自养菌)通过卡尔文循环固定CO2,但也有一些细菌使用其它的途径,如逆向TCA循环、厌氧的乙酰辅酶A途径和3-羟基丙酸循环等。
1. 逆向TCA 循环(reductive TCA cycle)
少数光合紫色细菌和绿硫细菌通过逆向TCA循环(也称为还原性TCA循环)固定CO2。譬如,热变形菌属(Thermoproteus)和硫化叶菌属(Sulfolobus)能通过逆向的TCA循环将CO2还原为乙酰辅酶A。另外,一种专性化能营养菌—嗜热氢杆菌(Hydrogenobacter thermophilus)不含有卡尔文循环的酶,但通过逆向TCA还原CO2。
逆向TCA反应的第一步是将乙酰CoA还原羧化为丙酮酸(固定1份子CO2),后者在丙酮酸羧化酶的催化下生成磷酸烯醇式丙酮酸(消耗一个ATP分子),随后被羧化为草酰乙酸(固定1份子CO2)而进入循环。草酰乙酸经一系列反应转化为琥珀酰辅酶A,再被还原羧化为α-酮戊二酸。α-酮戊二酸转化为柠檬酸后,裂解成乙酸和草酰乙酸。乙酸经乙酰辅酶A合成酶催化生成乙酰辅酶A(消耗1分子ATP),从而完成循环反应(图10)。
这样,每循环一次,固定4分子CO2,合成一分子草酰乙酸,消耗掉3分子ATP、2分子NAD(P)H和1分子FADH2。这几乎就是TCA循环的逆反应,在那里的产物是这里的消耗物,在那里的消耗物是这里的产物。TCA循环的本质是氧化与获能,而逆向TCA循环的本质是还原与耗能。
令人惊叹不已的是,TCA循环是有氧呼吸的核心过程,它将丙酮酸氧化为CO2和H2O,而在这里,其逆过程则被用于还原CO2,而不是用卡尔文循环。到底TCA循环来自逆向TCA循环,还是恰好相反?既然几乎是一种可逆过程,为何这两者不能在同一种细菌中存在?

图10 逆向TCA循环(引自Kim & Gadd 2008)
1, malate dehydrogenase; 2,fumarase; 3, fumarate reductase;4,succinyl-CoA synthetase; 5, 2-ketoglutarate synthase; 6,isocitratedehydrogenase; 7, aconitase;8, ATP:citrate lyase; 9,pyruvatesynthase; 10, PEP synthetase;11, PEP carboxylase.
2. 厌氧的乙酰辅酶A途径(anaerobic acetyl-CoA pathway)
厌氧的乙酰辅酶A途径 是厌氧的化能菌固定CO2的一种途径(图11),包括硫酸盐还原菌、产甲烷菌和产乙酸菌等。该途径有几个不同的名字,称为乙酰辅酶A途径是因这是最终产物,称为CODH途径是因为该酶的关键作用,也称为Wood–Ljungdahl途径是因为纪念阐明了该途径的学者。
甲酸脱氢酶(formate dehydrogenase)将CO2还原为甲酸,而甲酸结合到四氢叶酸(H4F)的一碳基团载体上而被还原为甲基—H4F,该甲基被转移到辅酶B12(类咕啉)上。第二个CO2分子在一氧化碳脱氢酶(Carbon Monoxide Dehydrogenase, CODH)的催化下还原为与酶结合的[CO],结合有[CO]的CODH从甲基类咕啉接受甲基而合成乙酰辅酶A。CODH是一个双功能酶,既催化CO氧化/CO2还原,又催化乙酰辅酶A合成/裂解,该酶也可被称为乙酰辅酶A合成酶。
2CO2 + 2NADH + 2H+ + 2Fd • H2 + CoASH +ATP →
CH3CO-CoA + 2NAD+ + 3H2O + 2Fd + ADP + Pi
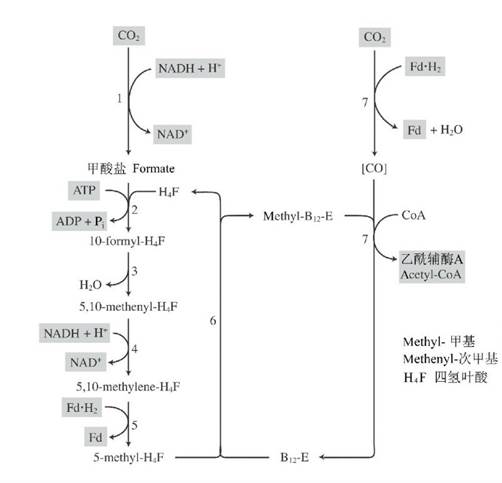
图11乙酰辅酶A途径—一种厌氧的CO2固定机制(引自Kim & Gadd 2008)
叶酸(Folic acid)是由喋啶(由吡嗪和嘧啶并联而成的二杂环化合物)、对氨基苯甲酸和谷氨酸残基组成的一种水溶性化合物,还原型衍生物称为四氢叶酸(Tetrahydrofolic acid)(图12)。叶酸作为重要的一碳载体,在核苷酸合成中扮演了重要角色,是DNA复制过程必需的一种辅酶,没有它,DNA复制就不能进行。虽然不像ATP和NADH之间在结构上的关联性那么强,也不排除叶酸与这两类重要物质在起源上的某种关联性。前两者都含有高能的磷酸键,分别是能量和氢的重要载体,而叶酸作为碳的载体,对早期生命过程中CO2的还原可能具有重要意义。看似同一类物质的3种不同的分化以通过承担不同的功能又整合性地完成同一个目的—CO2的还原。
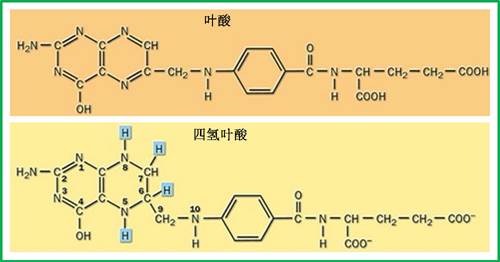
图12 叶酸和四氢叶酸(引自http://jpkc.scezju.com)
3. 其它途径
细菌固定CO2的方式除了卡尔文循环、逆向TCA循环和厌氧乙酰辅酶A途径外,还有几种其它途径。一种称为3-羟基丙酸循环,存在于嗜热光合细菌(如Chloroflexus aurantiacus),此循环的特征代谢中间物为 3-羟基丙酸。
在嗜热嗜酸古菌Metallosphaera sedula中还发现了3-羟基丙酸/4-羟基丁酸途径(3-hydroxypropionate/4-hydroxybutyrate pathway)(Berget al. 2007)。在嗜热古菌Ignicoccus hospitalis中发现了二羧酸/4-羟基丁酸途径(dicarboxylate/4-hydroxybutyrate pathway)(Huberet al. 2008)。
结语
在一切原核微生物的代谢中,ATP和NADPH(或NADH)的生产不可或缺,但实现途径的选择在不同类群中可以完全不同,ATP和NAD(P)H是后续合成代谢的最重要的基础。在原核生物中,CO2的还原方式也是十分多样,真可谓殊途同归啊!此外,还存在不依赖叶绿素的简洁的光合作用方式。电子传递链就是通过一系列的氧化还原反应来实现的,它是生命化学性的灵魂,在一切生命形式中都不可或缺。在电子传递链中,一个令人惊讶的现象就是细胞色素Cyt的普遍性,而Cyt与叶绿素在结构上的相似性暗示它们之间的同源关系,但叶绿素正是光系统的核心构建,而化能细菌为何要用如此复杂的电子载体呢?莫非这说明光能生物是最原始的祖先?
微生物在代谢上十分多样,这既反映了这类简单生物在生理与生态上的超强的可塑性,也反映了模式形成的偶然或随机性。同时,这也折射出原核微生物对多样的生存环境(尤其是一些极端)的极为灵活的适应性。即便如此,这种基于模式的对比性研究却很难判断时序性的演化过程,譬如,是利用叶绿素的光合作用古老,还是利用视紫红质的光合作用古老呢?还有,是化能自养菌古老,还是光能自养菌古老?
主要参考:《生命的起源—进化理论之扬弃与革新》(谢平著,科学出版社,2014)(http://wetland.ihb.cas.cn/lwycbw/qt/)
联系方式:沈宏 徐军 027-86780056 Email:wetland@ihb.ac.cn
地址:武汉市武昌区东湖南路7号
访问数量:


 当前位置:
当前位置: